Kontrolle pflanzlicher Endo- und Exozytose durch PIs
Zelluläre Membranen sind ständiger dynamischer Modifikation unterworfen. Endozytose und Exozytose sind wichtige Prozesse, die Membranlipide und integrale Membranproteine aus der Plasmamembran entfernen bzw. in die Plasmamembran inserieren können. PIs markieren Membranareale zur Rekrutierung verschiedener Proteine und sind so an der Kontrolle von Endozytose und Exozytose beteiligt. Viele Proteine, die Endozytose oder Exozytose beeinflussen, sind bekannt. In diesem Projekt untersuchen wir, welche dieser Faktoren maßgeblich durch PIs gesteuert werden. Durch ihre polarisierte Verteilung können PIs u.a. Membranbereiche definieren, aus denen bestimmte Proteine entfernt oder in die sie inseriert werden. Ein wichtiges Beispiel ist die Kontrolle der Balance von Recycling und Re-Insertion von PIN-Proteinen. Unsere Arbeiten sollen dazu beitragen, den Einfluss regulatorischer Membranlipide auf die Abundanz oder Polarisierung pflanzlicher integraler Membranproteine auf molekularer Ebene zu verstehen.
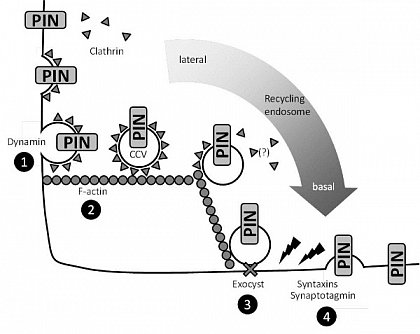
Endozytose, Exozytose und die Polarisierung pflanzlicher Zellen. Wichtige Prozesse, die bspw. der Polarisierung von PIN-Proteinen in Wurzelzellen von Arabidopsis zugrundeliegen: Zunächst in die Plasmamembran inserierte PIN-Proteine (oben links) werden durch Clathrin-vermittelte Endozytose (CME) internalisiert. Zunächst wird das Hüllprotein Clathrin an Membranbereiche rekrutiert, an denen Cargo-Proteine vorliegen ("Initiation"), was zur Bildung von clathrin-coated-pits führt. Clathrin-beschichtete Vesikel (CCVs) mit ihren Cargo-Proteinen werden durch Dynamine (1) von der Plasmamembran abgelöst ("scission") und entlang von F-Aktin-Strängen zum recycling-endosome transportiert (2). PIN-Proteine werden in ihren Membranzielbereichen wieder inseriert, wozu zunächst sekretorische Vesikel durch Komponenten des Exocyst-Komplexes an der Membran fixiert werden (3). Schließlich werden die Vesikel unter Beteiligung von Syntaxinen und Synaptotagmin am Zielbereich in die Membran fusioniert (4). Die Beteiligung von PIs an den beschriebenen Prozessen in Pflanzen ist momentan ungeklärt.


