Parvuline
Parvuline sind PPIasen, die in ihrer Primärstruktur nicht mit Cyclophilinen oder FKBP verwandt sind. Sie wurde nach dem ersten, 1994 entdeckten Mitglied der Familie aus Escherichia coli benannt, das sehr klein ist. Parvuline sind entweder kleine globuläre Proteine, die aus ca 100 Aminosäuren bestehen, oder größere Strukturen, die neben ein oder zwei Parvulin-Domänen noch andere Domänen besitzen. Die dreidimensionale Struktur von Parvulinen ist durch ein 4-strängiges antiparalleles Faltblatt, das von vier Helizes umgeben ist, charakterisiert. Aufgrund ihrer Substratspezifität werden Parvuline in zwei Gruppen unterteilt, die phospho-(Ser/Thr)-Pro-spezifische und die unspezifische Gruppe.
Das prominenteste Mitglied der phospho-(Ser/Thr)-Pro-spezifischen Parvuline ist das humane Pin1. Pin1 interagiert mit einer Vielzahl von Phosphoproteinsubstraten, die durch Phosphorylierung mit prolingerichteten Proteinkinasen entstehen, und beeinflußt dadurch die durch Phosphorylierung kontrollierten Signalwege. Die Spezifität der Parvuline des Pin1-Typ wird durch die Wechselwirkung des Phosphatrestes des Substrates mit einem Cluster basischer Aminosäurereste im aktiven Zentrum verursacht.
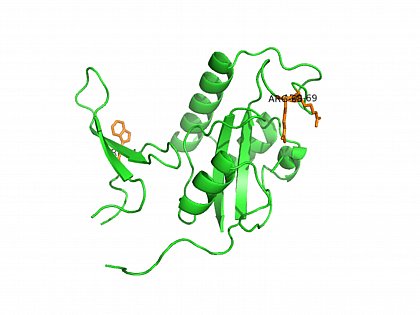
Röntgenkristallstruktur von Pin1. (PDB ID:1PIN,) orange: W34 in der WW-Domäne und Arg68, Arg69 im aktiven Zentrum der PPIase-Domäne von Pin1. Ranganathan, R., et al. (1997) Cell 89: 875-886
Pin1 und seine Orthologe enthalten eine WW-Domäne, die ebenfalls mit phospho-(Ser/Thr)-Pro-Gruppen interagiert. Durch diese Wechselwirkung wird häufig die Bindung von Pin1 an seine Proteinsubstrate vermittelt.
Pin1 wurde ursprünglich als Regulator der Mitose beschrieben. Später stellte es sich heraus, dass Pin1 Enzymaktivitäten, die Stabilität von Proteinen, Proteininteraktionen, Dephosphorylierungen und die subzellulare Lokalisation von Proteinen beeinflussen kann und so an der Kontrolle verschiedener zellulärer Prozesse, wie Transkription, Zellproliferation und Apoptose beteiligt ist.
Enzyme, die zur Gruppe der relativ unspezifischen Parvuline gehören, kommen sowohl in Pro- als auch in Eukaryoten vor. Par14, das zweite Parvulin neben Pin1 in Menschen, und auch das namensgebende Parvulin Par10 aus Escherichia coli gehören zu dieser Gruppe von Enzymen.


