Abt. Enzymologie - Peptidyl-Prolyl-cis/trans-Isomerasen
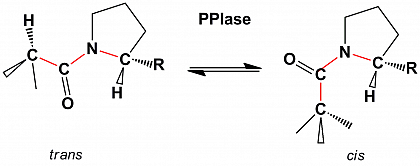
Aufgrund der eingeschränkten freien Drehbarkeit um die C-N-Bindung nehmen Peptidbindungen zwei bevorzugte Konformationen ein, die cis-Konformation und die trans-Konformation. Bei Peptidbindungen N-terminal zu Prolin (Prolylbindungen) befinden sich beide Isomere in einer ähnlichen sterische Situation, so dass cis-Isomer und trans-Isomer in unstrukturierten Peptiden in vergleichbaren Anteilen koexistieren.
Die cis/trans-Isomerisierung von Prolylbindungen ist aufgrund der relativ hohen Energiebarriere für die Rotation um den dihedralen Winkel w eine relativ langsame Reaktion.
Peptidyl-Prolyl-cis/trans-Isomerasen (PPIasen) sind ubiquitär verbreitete Enzyme, die die Umwandlung der zwei energetisch bevorzugten Isomeren, des cis-Isomer und des trans-Isomer von Prolylbindungen katalytisch beschleunigen.
Die cis/trans-Isomerisierung der Prolylbindungen bildet häufig einen langsamen kinetischen Schritt bei der Faltung und Umfaltung von Proteinen. Bei der Beschleunigung solcher langsamen Schritte der Proteinfaltung sind PPIasen von Bedeutung. Außerdem können PPIasen mit für sie spezifischen Substratproteinen in ihrem nativen Zustand interagieren. Dadurch sind PPIasen in der Lage, viele grundlegende Eigenschaften ihrer Zielproteine, wie ihre Bioaktivität, ihre Lokalisation und ihre Stabilität zu beeinflussen und damit Einfluss auf eine Vielzahl physiologischer und pathophysiologischer Prozesse zu nehmen.
Die PPIasen wurden 1984 von Gunter Fischer in Halle entdeckt.(https://de.wikipedia.org/wiki/Gunter_S._Fischer )
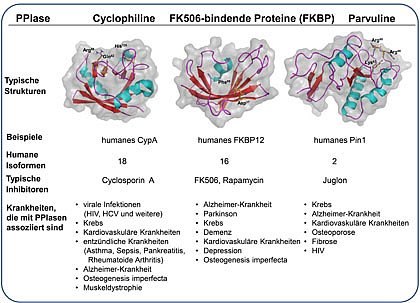
Zur Enzymklasse der PPIasen (EC 5.2.1.8) gehören drei verschiedene PPIase-Familien, die Cyclophiline, die FK506-bindenden Proteinen (FKBPs) und die Parvuline.
| Kontakt Cordelia Schiene-Fischer |
|---|

|
| Telefon: +49 345 55 22809 cordelia.schiene-fischer@biochemtech.uni-halle.de Abteilung Enzymologie |
| Postadresse: Martin-Luther-Universität Halle-Wittenberg Institut für Biochemie und Biotechnologie Abteilung für Enzymologie Cordelia Schiene-Fischer 06099 Halle (Saale) |





